
Биологический контроль осуществляется на всех этапах: до, во время и после инкубации.
Для оценки качества условий выведения молодника и режима инкубации, необходимо собирать сведения о качестве инкубационного яйца и условиях его прозводства, хранения, транспортирования. Учитываются такие показатели, как количество боя яиц во время упаковки, транспортировки и укладки в лотки, количество яиц, непригодных для инкубации и др. Важны данные по видам брака непригодных для инкубации яиц.
В промышленном птицеводстве используют приемы биологического контроля:
- оценку яиц до инкубации;
- прижизненную оценку развития зародыша;
- вскрытие яиц с погибшими эмбрионами;
- оценку качества суточного молодняка.
В период инкубации необходимо вести учет продолжительности инкубационного периода, так как чаще всего с нарушением развития зародыша удлиняются сроки инкубации и растягивается вывод.
Вскрытие яйца с живым зародышем позволяет непосредственно видеть, как он растет, как развиваются его оболочки, используются белок и желток.
Анализ динамики смертности зародышей отражает основные нарушения в их развитии и причины массовой гибели. Вскрытие яиц с мертвыми зародышами и самих зародышей позволяет определить, по специфическим внешним признакам, причины нарушений развития зародышей и их гибели.
К тем или иным приемам прибегают только по мере необходимости. При высоком проценте вывода молодняка большинство приемов контроля исключают.
1. Биологический контроль до инкубации.
Оценка качества инкубационных яиц позволяет судить о физиологическом состоянии родительского стада, условиях кормления и содержания птицы. Контроль качества яиц включает:
- Визуальную оценку по внешнему виду и при просвечивании яиц с сортировкой по качеству и разделением на: стандартные (без дефектов), условный брак (с одним незначительным дефектом) и явный брак (непригодные к инкубации).
- Выборочный контроль пробы из партии яиц по морфологическим, физико-химическим и биохимическим показателям.
До инкубации применяются приемы биологического контроля:
- внешний вид яиц (размеры, чистота и качество скорлупы, однородность по форме и величине);
- масса яиц;
- овоскопирование яиц (исследование внутренней структуры яйца, подвижности желтка и интенсивности его окраски); просвечиваемости скорлупы, наличию включений в белке и желтке, состоянию зародышевого диска;
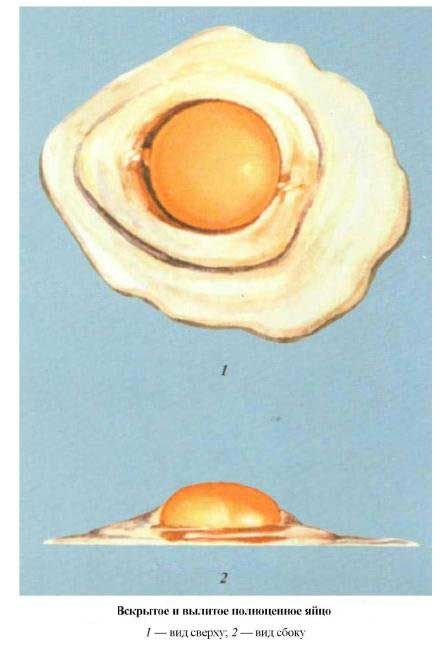
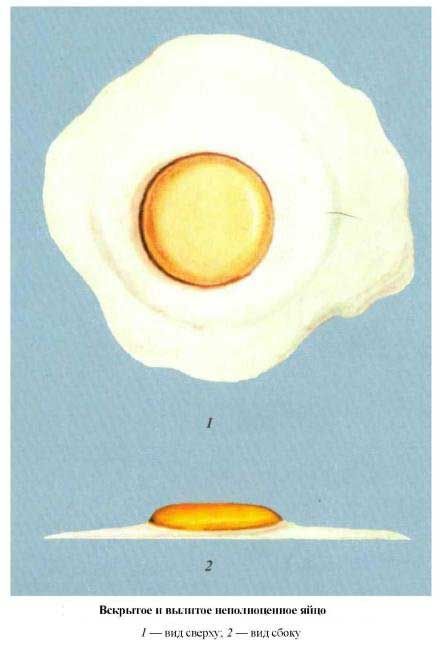
- вскрытие яиц (индекс белка и желтка, цвет желтка, оплодотворенность зародышевых дисков).
Если в целом качество яиц удовлетворяет требованиям, то детальную оценку дают только 5-10% общего количества инкубируемых яиц.
 |
 |
|
Вскрытое и вылитое полноценное яйцо |
Вскрытое и вылитое неполноценное яйцо |
Стандартные инкубационные яйца должны иметь:
- правильную форму;
- чистую и гладкую скорлупу;
- воздушную камеру в тупом конце яйца или чуть смещенную в сторону (диаметр ее в свежем курином яйце не превышает 1,5 см.);
- желток занимает центральное положение или немного смещен к воздушной камере, малоподвижен при вращении яйца.
К условному браку относят яйца с:
- мраморной скорлупой;
- незначительными известковыми наростами;
- «поясами» (внутренняя трещина), удлиненной или округлой формы;
- небольшими загрязнениями в виде точек или полос общей площадью не более 3 см2.
Непригодными к инкубации следует считать яйца, у которых одновременно имеется несколько дефектов.
К явному браку относят яйца:
- очень мелкие или крупные,
- двух- или трехжелтковые,
- асимметричные или уродливые по форме,
- с большой или подвижной камерой,
- битые,
- с насечкой,
- с шероховатой хрупкой скорлупой,
- бесскорлупные,
- при наличии различных включений (кровяные, мясные, плесень),
- с оторванными градинками,
- разлитым желтком,
- загрязненные пометом, слизью, кровью.
При оценке яиц по внешнему виду и при просвечивании на овоскопе учитывают размер и форму яиц, состояние скорлупы, размеры и положение воздушной камеры, наличие трещин (насечка, бой) в скорлупе, различного рода включения в яйцах, положение и подвижность желтка, состояние градинок.
|
|
|
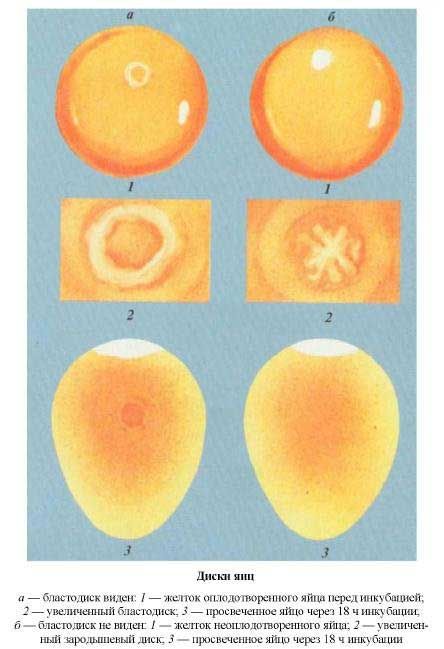
| Диски яиц |
Яйца не пригодные для инкубации |
2. Биологический контроль во время инкубации.
Прижизненный контроль.
Еженедельное контролирование развития эмбрионов в инкубируемых яйцах - это оперативная информация о проблемах в кормлении родительского стада и в нарушениях режимов инкубации.
Контроль в процессе инкубации включает:
- Прижизненную оценку развития эмбрионов в контрольные дни овоскопированием яиц;
- Учет эмбриональной смертности по периодам инкубации;
- Учет потери массы яиц путем их взвешивания в контрольные дни.
- Вскрытие яиц с живыми зародышами для оценки степени их развития (при необходимости).
- Учет продолжительности инкубации и интенсивности вылупления.
Эмбриональная смертность особенно высока в периоды, получившие название «критические». Для кур это обычно 3-5, 9-11 и 19-20 сутки инкубации. При низком качестве яиц или значительных нарушениях режима инкубации смертность эмбрионов может распределяться иначе.
2.1. Овоскопирование.
Основной прием "неразрушаюшего" биологического контроля во время инкубации - овоскопирование (просвечивание яиц), позволяет:
- оценить рост и развитие эмбриона, и его оболочку;
- проследить, как используются зародышем белок и желток;
- установить количество неоплодотворенных яиц;
- выявить яйца с мертвыми зародышами (тухляки) и примерные сроки их гибели.
Во время инкубации основной прием "неразрушающего" биологического контроля — овоскопирование яиц. Сроки овоскопирования яиц птицы разных видов приведены в таблице ниже.
| Вид птицы | № овоскопирования, сутки | ||
| 1 | 2 | 3 | |
| Куры | 6,5-7,5 | 10,5-11 | 18,5-19 |
| Утки | 7,5-8 | 12,5-13 | 24,5-25 |
| Гуси | 9,5-10 | 14-15 | 27,5-28 |
| Индейки | 8-8,5 | 12-13,5 | 24,5-25 |
Первое овоскопирование.
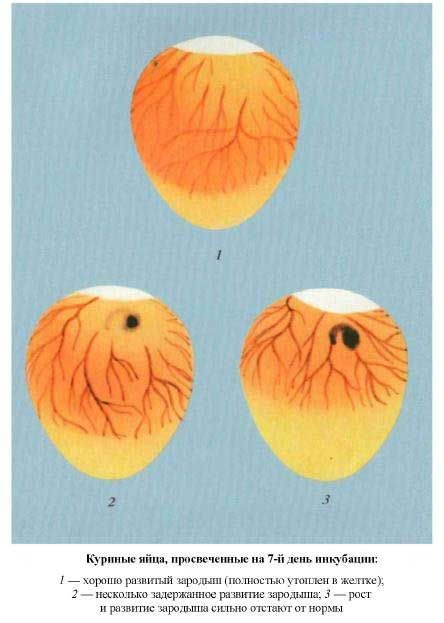
Оценивается состояние живых зародышей по расположению в яйце кровеносных сосудов и величине воздушной камеры.
Выбраковывают неоплодотворенные яйца и яйца с пороком «кровяное кольцо» (на поверхности желтка хорошо видны кровеносные сосуды в виде кольца неправильной формы).
Второе овоскопирование.
Признак хорошего развития - замыкание аллантоиса на остром конце яйца.
 |
 |
|
Куриные яйца. Овоскопирование на 7-ой день инкубации. |
Куриные яйца. Овоскопирование на 12-ой день инкубации. |
 |
 |
|
Куриные яйца. Овоскопирование на 20-ой день инкубации. |
Яйца с мертвыми зародышами погибшими во время инкубации |
Третье овоскопирование.
Хорошо развивающийся зародыш цыпленка занимает примерно 2/3 яйца, воздушная камера большая, ее границы волнисты и подвижны. Малая воздушная камера и отсутствие движений эмбриона - признак погибшего зародыша.
Все яйца с погибшими эмбрионами учитывают и относят к категории «замершие». Погибших после третьего просвечивания в период вывода относят к категории «задохлики».
2.2. Взвешивание яиц.
Простой, но эффективный прием контроля — учет потери яйцами влаги. Для этого периодически взвешивают яйца:
- перед закладкой в инкубатор;
- на 7-е сутки инкубации;
- на 12-е сутки инкубации;
- на 19-е сутки инкубации.
В норме за 19 сут. инкубации куриные яйца теряют 12-13 % первоначальной массы.
2.3. Определение возраста эмбриона.
Во время эмбрионального развития между зародышем, желтком, белком и скорлупой происходит постоянный обмен веществ, особенности которого изменяются с возрастом. Эмбрион ассимилирует питательные вещества, выделяет и частично резервирует в нем продукты диссимиляции, поглощает и выделяет тепло. При этом изменяются строение, внешний вид и размеры эмбриона.

У эмбрионов появляются и временные (провизорные) органы, находящиеся вне его тела и функционирующие только до вывода из яйца. Их называют эмбриональными оболочками. Между стенками аллантоиса накапливаются продукты обмена веществ. После вывода остаются части скорлупы и неиспользованные подскорлупные оболочки, аллантоис, амнион.

Самая наружная внезародышевая оболочка, примыкающая к скорлупе и поэтому служащая местом обмена между зародышем и окружающей его средой, называется Хорионом. Основная функция хориона — осуществление дыхательного газообмена.
Полость между хорионом и амнионом – хорионамниотическая.
Амнион (греч. Amnion), Амниотический мешок или Водная оболочка — одна из зародышевых оболочек у эмбрионов пресмыкающихся, птиц, млекопитающих. Эволюционно амнион возник для защиты эмбрионов от высыхания при развитии вне водной среды. Поэтому позвоночных животных, откладывающих яйца (рептилии и птицы), а также произошедших от рептилий млекопитающих относят к группе амниот («Животные с яйцевыми оболочками»). Предшествующие классы и надклассы позвоночных (головохордовые, круглоротые, рыбы, земноводные) откладывают икру в водную среду, поэтому им не требуется водная оболочка. Эти классы животных объединяют в группу анамний. В отличие от анамний амниотам не требуется водная среда для размножения и раннего развития, поэтому амниоты не привязаны к водоемам. В этом состоит эволюционная роль амниона.
При родах млекопитающих водная оболочка лопается, воды вытекают, а остатки амниона на теле новорождённого часто называют «рубашечкой», которая повсеместно с давних времён является знаком удачи и прочих суеверий (отсюда, в частности, русская поговорка про тех, кто «в рубахе родился»).
Аллантоис (от греч. "колбасовидный") — эмбриональный орган дыхания высших позвоночных животных; зародышевая оболочка, развивающаяся из задней кишки эмбриона. Кроме того, аллантоис участвует в газообмене зародыша с окружающей средой и выделении жидких отходов. У яйцекладущих птиц и рептилий аллантоис развивается вокруг эмбриона вдоль стенок скорлупы. В своём внешнем слое, называемым мезодермой, он создаёт разветвлённую сеть кровеносных сосудов, с помощью которых происходит взаимодействие с внешней средой.
Аллантоис, вкупе с другими эмбриональными оболочками — амнионом и хорионом, является определящим признаком высших позвоночных животных — млекопитающих, птиц и рептилий.
В основу определения возраста эмбрионов взято развитие тех или иных органов и временных эмбриональных оболочек. использование белка и желтка, амниотической жидкости, готовность к вылуплению и т.д. В процессе эмбриогенеза происходит потребление всех питательных веществ яйца – белка и желтка.
 |
 |
|
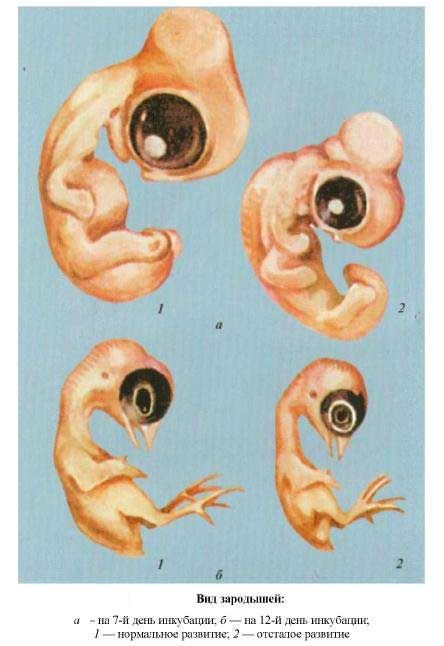
Виды зародышей на 7 и 12 дни |
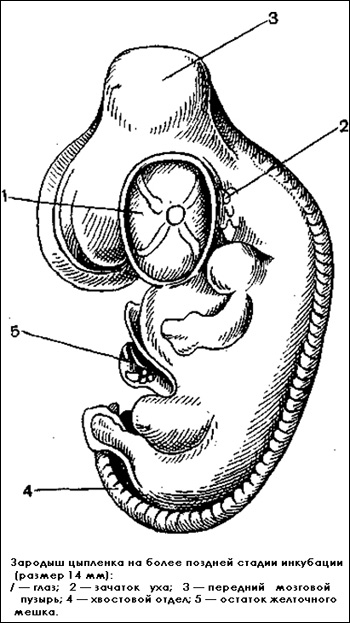
Виды зародышей на поздней стадии |
|
|
|
2.4. Патолого-анатомический анализ.
Выявление причин смертности эмбрионов.
В основу определения возраста эмбрионов взято развитие тех или иных органов и временных эмбриональных оболочек, использование белка и желтка, амниотической жидкости, готовность к вылуплению. При вскрытии эмбрионов важной является оценка их по возрастным признакам (день инкубации), по которым при сравнении со стандартными показателями можно судить о соответствии возраста эмбриона и степени его развития.
 |
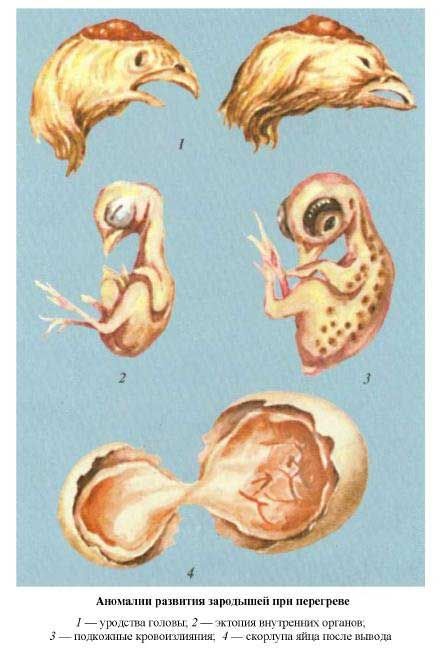 |
| Аномалии развития зародышей при недогреве | Аномалии развития зародышей при перегреве |
 |
 |
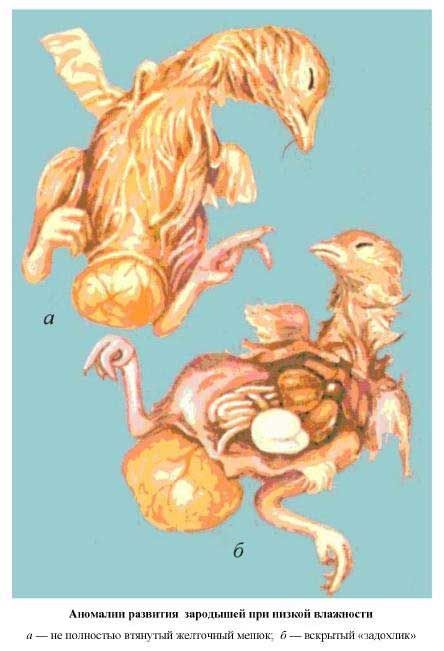
| Аномалии развития зародышей при низкой влажности | Аномалии при нарушении влажностного режима при инкубации |
 |
|
| Болезни зародышей | |
Если вывод сосотавляет менее 78-80% рекомендуется проводить вскрытие погибших эмбрионов. Без учета источников поступления конкретного инкубационного яйца (родительского стада, условий хранения и транспортирования инкубационного яйца) - результаты вскрытия часто не имеют ценности.
3. Биологический контроль после инкубации.
Послеинкубационный биологический контроль включает:
- Учет и анализ результатов инкубации;
- Оценку суточного молодняка по экстерьерным и морфо-биохимическим показателям;
- Распределение некондиционного молодняка по видам брака (если их количество превышает 2%);
- Патологоанатомический анализ и выявление причин смертности эмбрионов;
- Контроль за сохранностью молодняка в первые 10 дней выращивания.
Оценку результатов инкубации проводят выборочно по контрольным лоткам, взятым из разных зон промышленного инкубатора или по всей партии яиц. При этом учитывают вывод молодняка, выводимость яиц, количество слабого молодняка и калек.
Вывод молодняка - это количество выведенного кондиционного молодняка от числа заложенных яиц, выраженное в процентах.
Выводимость яиц - это количество выведенного кондиционного молодняка от числа оплодотворенных яиц, выраженное в процентах.
Слабый молодняк и калеки - это количество выведенного некондиционного молодняка от числа заложенных яиц, выраженное в процентах.
3.1. Интенсивность вылупления.
О качестве инкубации можно судить, прежде всего, по срокам наклева и вывода молодняка. Слишком ранний наклев и вывод чаще всего связаны с перегревом яиц во время инкубации, поздний — с недогревом или неполноценными яйцами.
Растянутый наклев и вывод обычно являются следствием нарушения эмбрионального развития из-за действия каких-то негативных факторов. Отклонения в продолжительности инкубации не всегда снижают выводимость, но очень часто ухудшают качество выведенного молодняка, его последующий рост и жизнеспособность.
Время выборки молодняка следует рассчитывать с учетом возраста птицы, породы и кросса, так как от молодой птицы, легких пород и кроссов молодняк выводится несколько раньше, чем от переярой или тяжелых пород.
Промежуток времени от вылупления первых цыплят в партии до последних характеризует энергию их вылупления в партии, которая зависит от режима инкубации, качества яиц, их массы, срока хранения, а также от возраста и породы птицы. Учет энергии вылупления основан на наблюдении за характером вывода молодняка.
Для этого составляют график выборки, по которому через равные промежутки времени (через 4 или 6 ч) вынимают пустые скорлупки вылупившихся цыплят. Их количество записывают в соответствующей графе. Выборку скорлупок продолжают до конца вывода всех цыплят в партии.
Средняя продолжительность инкубации партии яиц рассчитывается с использованием математических методов статистического анализа. Определяются численные значения:
- средний час вылупления;
- ошибка вычисления среднего часа вылупления;
- среднее квадратическое отклонение от средней величины.
Величина средне квадратического отклонения и характеризует собой энергию вылупления: чем она меньше, тем дружнее проходил вывод.
3.2. Выводимость.
По окончании инкубации получают заключительный показатель — выводимость (количество выведенного здорового молодняка в процентах от количества оплодотворенных яиц). Этот показатель имеет решающее значение, если он рассчитывается для каждого источника поступления яиц для инкубации.
3.3. Отбраковка молодняка.
По экстерьерным и морфо-биохимическим показателям.
Для характеристики всего процесса инкубации важна оценка молодняка по внешнему виду в суточном возрасте, и оценка сохранности и роста молодняка птицы, особенно в первые недели выращивания.
Качество суточного молодняка зависит от биологической полноценности яиц, режима инкубации и от условий, в которых находится молодняк со времени вылупления до транспортировки его в цех выращивания.
Суточный молодняк.
Используют следующие методы оценки:
- визуальный - по экстерьерным признакам;
- взвешивание;
- выборочное вскрытие с целью морфологического и биохимического анализов.
При экстерьерной оценке свободно размещенный в лотке молодняк осматривают, обращая внимание на активность и подвижность. Слабых и калек отсаживают в отдельные ящики, а остальных подвергают дополнительной оценке.
Здорового птенца берут в руку так, чтобы спина его касалась ладони, а живот был охвачен большим и указательным пальцами и осматривают:
- размер живота;
- состояние остаточного желтка;
- пупочное кольцо;
- клоаку;
- голову;
- клюв;
- глаза;
- ноги;
- пух.
Подробнее в статье "Где пупок у цыпленка и почему это важный признак качества?"
Первые 2 недели.
Основной отход птенцов наблюдается именно в этот период.
Хороший показатель качества яиц и соблюдения режима инкубации — высокая сохранность и большая живая масса молодняка в первые 2 недели жизни:
- При правильном режиме инкубации биологически полноценных яиц, отход к концу первой недели за счет слабых и больных птенцов на уровне 1-2 %.
- При выращивании цыплят, полученных из биологически неполноценных яиц или со значительными нарушениями режима инкубации, в первые 2 недели отход молодняка значительно повышается и может составить 15 % и более от принятых на выращивание.
4. Санитария инкубационных яиц.
К эмбриональной смертности, слабости цыплят и слабому росту, а также их смертности способствуют чуждые микроорганизмы проникающие через скорлупу инкубируемых яиц.
Санитарии начинается с обработки яиц сразу после сбора из гнезд и как можно раньше.
Для снижения численнности микроогранизмов на поверхности скорлупы, инкубируемые яйца обрабатывают с использованием фумиганта или других типов дезинфектантов. Но для хорошей выводимости яиц с высоким качеством молодняка также важна и санитария здания инкубатория, оборудования, транспортных средств, и.т.д.
При выборе санитарного средства для дизенфекции надо во внимание принимать как положительные так и негативные свойства от применения их на:
- здоровье человека: опасности от прямого контакта (вдыхание, глаза, кожа и всасывание), канцерогенность, мутагенность, и токсический эффект на воспроизводство;
- окружающую среду и методы очистки предных продуктов разложения;
- потенциальной опасности пожара;
- стабильность во времени и коррозионные свойства,
а так же удобство (простота) использования и необходимых мерах предосторожности.
В основном используют озон, четвертичный аммоний (quaternary ammonium), йодные комплексы, фенолы, галогены, альдегиды, соли, спирты, кислоты, и различные комбинации.
Им соответствуют торговые названия продуктов: формальдегид, Глутацид (Glutacide), Квот 800 (Quat 800), Джермекс (Germex), Квом (Quam), Супер Квом (Super Quam), Триад (Tryad), Эгг Вош (Egg Wash), Каверидж 256 (Coverage 256), Basic G & H, Iocide-14, Iodophor, Lysovet, 1-Stroke, Tektrol, D.O.C., гипохлорид или белизна, Chlorwash, Bioguard, H Peroxide, Virkon, Sanimist, и озон.
Большинство из веществ следует использовать в защитной одежде, следует принимать меры предосторожности при вдыхании и контакте с глазами и кожей:
- сильно опасные для глаз, кожи и дыхательной системы: белизна, формальденид, озон и Tektrol;
- ограниченно опасны для человека и окружающей среды: белизна, перекись и озон.
Относительно безвредны для человека и окружающей среды: Bioguard, Germex, Iocide-14, Lysovet, Super Quam, Chlorwash, Quam, Quat 800, 1-Stroke, и Coverage 256.
4.1. Эффективность против микроорганизмов.
Эффективность, приведенных выше вещества, против различных микроорганизмов на поверхности скорлупы:
- Все средства санитарии (исключение Basic G & H, Sanimist, и озон) способны значительно снизить количества микроорганизмов на поверхности скорлупы;
- Активный ингредиент в Sanimist, двуокись хлора, реагирует с протеином кутикулы скорлупы, который нейтрализует его до того как эффективно воздействовать на микроорганизм;
- Хотя свежеприготовленный раствор Virkon и эффективен, но хранение в течение 7 дней вызывает потерю его действия;
- Средства санитарии, основанные на феноле, такие как Tektrol, D.O.C. и 1-Stroke, менее эффективны, чем Lysovet-другое фенольное соединение, которое также содержит EDTA (поверхностно-активный и смачивающий агент).
Инкубатории проверяются на эффективность санитарных средств путем взятия проб воздуха, смыва с поверхностей, пуха или других методов.
Прединкубационная обработка яиц санитарными средствами, которые показывают остаточный эффект может быть также полезна в предотвращении перезаражения в ходе инкубации.
4.2. Влияние на эмбрион.
Некоторые из указанных веществ вызывали смерть эмбриона и потерю выводимости:
- Virkon, Coverage 256 и Egg Wash, которые содержат EDTA, могут снижать выводимости яиц от 11 до 26%. Они также могут способствовать потере влаги ниже нормы в ходе инкубации от 16 до 19% меньше, чем стандарт обработанный формальдегидом.
- Перекись может способствовать увеличению потери влаги из яиц, но не оказывает влияния на выводимость яиц.
4.3. Использование ультрафиолетового света и фильтрации воздуха
Недавние исследования показали эффективность использования УФ света, как удобного в использовании, безопасного метода санитарии инкубируемых яиц и как средство для обработки циркулирующего воздуха в инкубаторе.
Прединкубационная обработка яиц УФ светом (254 nm) в течение 1, 3, или 5 минут значительно менее эффективен против бактериальной флоры на скорлупе, чем погружение яиц в 1% формалин на 1, 5, или 10 минут.
УФ обработанные яйца немножко меньше теряют влаги в ходе инкубации, но выводимость не снижается.
Яйца, обработанные формалином перед закладкой, и затем инкубированные с УФ с системой фильтрации воздуха показали меньшую бактериальную загрязненность и большую выводимость (77.4 против 71.4%). Поздняя эмбриональная смертность была снижена почти на 30%.
4.4. Время дезинфекции яиц и способ обработки.
В случае контаминации инкубируемых яиц хорошей защитой является лучшее нападение. Поэтому, хорошая программа санации, которая предотвращает заражение яиц, является значительно лучшим решением, чем дезинфекция яиц после заражения. В лучшем случае, дезинфекция эффективна только частично.
Типы организмов и незамедлительность обработки играют ключевую роль в успехе дезинфекции.
Это было показано в исследованиях, в которых скорлупа инкубируемых яиц была заражена сальмонеллой. Яйца затем были обработаны одним из нескольких дезинфектантов в течение 1 мин., 5 мин., 4 или 24 часов после заражения. В среднем, наблюдали 77% снижение степени заражения, когда яйца обрабатывались 1 мин. 64% - 5 мин, 45% - 4 часов, и менее 10% -24 часов. Таким образом, промежуток времени между заражением и обработкой дезинфектантом играет важную роль в эффективности дезинфектанта.
Погружение яиц в дезинфектант более эффективно чем распыление, что в свою очередь был более эффективно, чем пена.
Глутаральдегид, четвертичный аммоний и вирицид оказались неэффективными. Полигексаметиленбигуанид гидрохлорид (PHMB), перекись водорода (1%), и фенол (0.2%) были наиболее эффективны: 95, 94, и 80% снижение зараженности, соответственно, в зараженных яйцах при обработке в течение 1 минуты после инокуляции и 95, 44, и 69% снижение при обработке через 5 мин.
На результаты дезинфекции сильное влияние оказывают время обработки и тип дезинфенктанта. Тип организма тоже играет большую роль. Более того, благотворное влияние дезинфектанта на выводимость яиц может оказаться неутешительным. В недавнем исследовании, где изучалось влияние дезинфекции на выводимость чистых и грязных яиц, показало, что этот показатель меняется в пределах от 0 до 2%.
Хотя дезинфекция яиц часто помогает в снижении зараженности инкубируемых яиц, необходимо помнить, что это не панацея и нужно предпринимать все меры чтобы получить чистые яйца, которые не нуждаются в дезинфекции.

/cf29a106bbd89dc.ru.s.siteapi.org/img/3zxclsqqtxk4k8o4ogw8s8sosoc0k0)